Stabilität von Carbanionen
Im letzten Post berichtete ich über ein neuartiges Carbanion, welches ausschließlich von Trichlorsilylgruppen stabilisiert wird (siehe Abb. 1). Welche Substituenten sind überhaupt in der Lage Carbanionen zu stabilisieren? Was sind das für Substituenten, was für Eigenschaften müssen diese haben?
Abbildung 1: Neuartiges hoch symmetrisches Carbanion (Eur. J. Inorg. Chem. 2016, 5028-5035)
Ein Methanidion CH3- besitzt eine negative Ladung. Diese ist weitghend am Kohlenstoffatom lokalisiert. Dadurch ist dieses Anion sehr energiereich und damit hoch reaktiv. Ein solches Anion reagiert sofort mit jedem verfügbaren Reaktionspartner. Durch geeignete Substituenten können Cabanionen stabilisiert werden. Folgende generelle Prinzipien zur Stabilisierung von Carbanionen können aufgezählt werden:
1. Elektronenziehende Substituenten stabilisieren Carbanionen, indem sie Elektronendichte vom negativ geladenen Kohlenstoffatom aufnehmen. Die elektronenziehende Wirkung solcher Substituenten werden in der organischen Chemie als induktive und mesomere Effekte klassifiziert. Ein elektronenziehender induktiver Effekt (-I ) wirkt über die sigma-Bindung. Ein elektronenziehender mesomerer Effekt (-M) wirkt über pi-Bindungen.
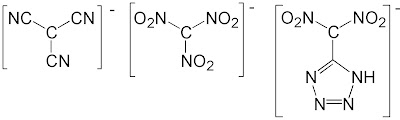
Beispiele für Substituenten mit -I-Effekt sind Fluoratome und wie wir seit jüngstem wissen Trichlorsilylgruppen. Beispiele für Substituenten mit -M-Effekt sind Nitrogruppen (NO2), Cyanogruppen (CN) und verschiedene Sulfonate und andere Gruppen mit S=O-Doppelbindungen.
Abbildung 2: Beispiele für Carbanionen mit elektronenziehenden Substituenten (Literaturstellen am Ende des Posts)
2. Aromaten und andere Systeme mit Doppelbindungen können ebenfalls Carbanionen stabilisieren. Im einfachsten Fall genügt schon eine Substitution mit mehreren Phenylgruppen zur Stabilisierung eines Carbanions. Sehr viele Varianten dieses Grundmusters sind möglich: Naphthylgruppen, Diphenylderivate, substituierte Phenylgruppen wie para-Fluorophenyl oder Pentafluorophenyl.
Abbildung 3: Beispiel für ein durch Aromaten stabilisiertes Carbanion (Literaturstellen am Ende des Posts)
3. Silylsubstituenten sind offensichtlich ebenfalls in der Lage Carbanionen zu stabilisieren. Es gibt in der Literatur eine Reihe von Beispielen bei denen Silylsubstituenten für diesen Zweck genutzt wurden. Diese besitzen meist zusätzlich sterisch anspruchsvolle Gruppen wie tert-Butyl oder Aromaten.
Abbildung 4: Carbanionen mit Silyl-Substituenten (Literaturstellen am Ende des Posts)
4. Phosphorylide sind sozusagen "verkappte" Carbanionen. Die negative Ladung des Carbanions wird hier durch die Wechselwirkung mit einer Triorganylphosphinogruppe stabilisiert. Ich wurde kürzlich von Hubert Schmidbaur darauf aufmerksam gemacht, dass er bereits in den 1970er Jahren Ylide untersuchte, die unter anderem auch durch Trichlorsilylgruppen stabilisiert wurden.
Abbildung 5: Beispiele für Phosphorylide mit Silyl-Substituenten (oben) und allgemeine Grenzstrukturen für Phosphorylide (unten)
Literaturstellen:
Elektronenziehende Substituenten:
- P. Andersen, B. Klewe, Nature 1963, 200, 464-464.
- J. R. Witt, D. Britton, Acta Cryst. 1971, B27, 1835-1836 and references cited therein.
- M. Göbel, T. M. Klapötke, Z. Anorg. Allg. Chem. 2007, 633, 1006-1017.
- T. M. Klapötke, F. X. Steemann, Propellants Explos. Pyrotech. 2010, 35, 114-129.
- W. Schlenk, J. Holtz, Ber. Dtsch. Chem. Ges. 1916, 49, 603-608.
- S. Harder, Chem. Eur. J. 2002, 8, 3229-3232.
- A. I. Almansour, C. Eaborn, S. A. Hawkes, P. B. Hitchcock, J. D. Smith, Organometallics 1997, 16, 6035-6037.
- N. Wiberg, G. Wagner, G. Reber, J. Riede, G. Müller, Organometallics 1987, 6, 35-41.
- H. Li, A. J. A. Aquino, D. B. Cordes, F. Hung-Low, W. L. Hase, C. Krempner J. Am. Chem. Soc. 2013, 135, 16066-16069.
Phosphorylide:
- H. Schmidbaur, W. Malisch, Angew. Chem. 82, 1970, 84-85.
- H. Schmidbaur, W. Malisch, Chem. Ber. 1970, 103, 3007-3018.
- H. Schmidbaur, W. Malisch, Chem. Ber. 1971, 104, 150-159.
- K. E. Krahulic, H. M. Tuononen, M. Parvez, R. Roesler, J. Am. Chem. Soc. 2009, 131, 5858–5865.




Keine Kommentare:
Kommentar veröffentlichen